|
|
凋亡诱导剂的影响
不同的药物或刺激因素对同一细胞系或组织可能会产生不同的影响。对某一种细胞系,一些制剂可能会没有作用,而另外一些制剂可能会诱导细胞出现坏死,而非凋亡,或是诱导出不同途径的凋亡。例如,如果希望诱导HeLa细胞的凋亡,应使用蛋白激酶C抑制剂—十字孢碱处理细胞,而不能使用抗Fas单克隆抗体诱导,因为HeLa细胞缺失Fas受体。对于大多数细胞或组织,一些方法如使用激酶抑制剂处理、紫外线照射或X-射线照射等手段可引起更有效的凋亡。但是,我们建议您仔细地选择合适的凋亡诱导剂。请查阅文献或进行预实验,确认您所使用的诱导剂确实能够诱导受试细胞系的凋亡。www.promega.com/apoasst/ 网页为Promega公司提供的免费的凋亡帮助软件,是一个非常有用的资源。
药物浓度或刺激强度和暴露时间的影响
药物使用浓度和刺激强度也会影响细胞的反应。较低的药物浓度可能不会对细胞产生预期的影响,或产生未加预期的效应。例如,使用较低浓度的强心苷乌本苷、毒毛花苷K、地高辛和地高辛素处理HeLa细胞后,通过结晶紫染色测定吸光度,发现细胞生长没有被抑制,反而被促进了。在较高浓度下,相同的药物则诱导细胞出现凋亡(16)。如果使用了不当的高浓度或高强度的凋亡刺激手段,则细胞可能会出现坏死而非凋亡。
暴露时间也会对细胞凋亡的诱导产生影响。一般情况下,如果诱导凋亡的药物浓度较低或诱导刺激方法的强度较低,药物需要的暴露时间就长。这样EC50值会随着暴露时间的延长而降低(9,16)。当HeLa细胞暴露于较低浓度的强心苷48小时时,药物会促进细胞增长,而当暴露72或96小时时,该药物既不会促进也不会抑制细胞的增长。在较高的药物浓度下,随着暴露时间的增加,药物对细胞增长的抑制作用更为明显。因此,细胞对某一毒素或损伤的暴露时间可能会对实验结果和结论产生很大影响。看起来没有效应或没有短期效应的处理方式可能会在长时间处理后产生极为不同的效应。
即使是在可以诱导出凋亡的条件下,某一特异的凋亡事件发生的时间也会随着暴露时间的变化而变化。在他莫昔芬处理的HepG2细胞中,caspase-3活性的达峰时间依赖于药物浓度,并且也与药物暴露时间相关(图3;17)。在较高浓度的他莫昔芬处理下,caspase-3活性的达峰时间为药物作用后1-2小时,而当使用的他莫昔芬浓度较低时,直到更长的暴露时间(24小时),caspase-3的活性也没有达到峰值。我们建议进行预实验,建立初始的剂量效应曲线,以确定诱导目的细胞或组织凋亡所需的合适的药物浓度或刺激强度。请在足够长的时间段内、并在间隔适当的多个时间点来检测凋亡事件,以确保捕捉到峰活性。
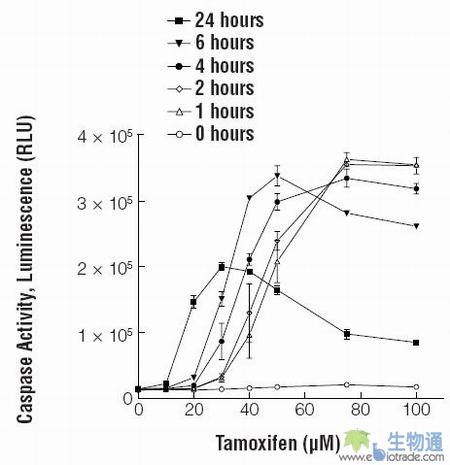
图3. 使用0-100μM他莫昔芬处理HepG2细胞0-24小时后,caspase-3的活性检测结果。按25000个细胞/孔的密度接种HepG2细胞于96孔培养板,过夜培养。使用RPMI培养基进一步稀释溶解在DMSO中的他莫昔芬贮存液,以间隔时间加入。所有不加他莫昔芬的培养孔都含有终浓度为0.2%的DMSO。使用 Caspase-Glo® 3/7试剂盒检测caspase-3/7的活性。加入他莫昔芬后,在适当的时间点加入Caspase-Glo® 3/7试剂(100μl/孔),在检测发光强度前,预先将待分析的细胞板在室温下孵育1小时。无细胞的对照培养基的发光值是708 ± 68(数据未显示)。数据以均数±标准差(n=3)表示。图片的引用得到了以下授权: Moravec, R. and Riss, T (2004) ASSAY Drug Dev. Tech. 2, 1–12.
细胞培养条件的影响
如上所述,检测凋亡所使用的细胞系对实验结果也会产生很大的影响。然而,人们可能对于细胞培养条件也会对结果产生影响这一事实还了解较少(9)。一些因素如细胞密度、传代次数和亲本储存细胞生长的密度都可能会对细胞生理学产生影响,从而也会影响细胞对刺激物的反应能力。 如果细胞数量较多,可能会产生保护性作用;药物可能会非特异地结合在细胞表面或培养基中的细胞蛋白上,从而降低了有效的药物浓度。使用递增浓度的他莫昔芬处理不同密度的HepG2 细胞时,发现药物的效能会随着细胞数量的降低而增加(EC50值降低)(图4)。由于caspase-3/7活性的达峰时间随着他莫昔芬浓度的降低而增加(图3),这表明当使用的细胞数量较多时,要检测某一特异的凋亡事件所要求的药物暴露时间也会更长。在准备研究凋亡的受试细胞时,请确保要遵循完善建立的细胞培养程序,并使每次实验的细胞数量一致,从而将这些因素的影响减至最低。
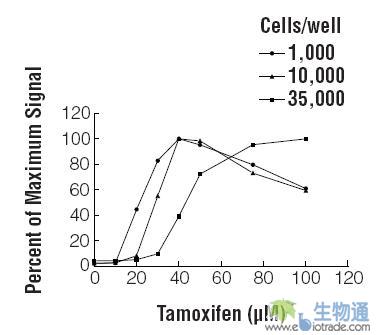
图4. 细胞数量对caspase激活时限的影响
按照1,000, 10,000或者35,000个细胞/孔的密度接种HepG2细胞于96孔培养板,将细胞暴露于不同浓度的他莫昔芬中4个小时。使用 Caspase-Glo® 3/7试剂盒检测caspase-3/7活性,结果以每一细胞密度的最大信号的百分比表示。所用数据点以均数±标准差(n=3)表示。图片的引用得到了以下授权: Moravec, R. and Riss, T, (2004) ASSAY Drug Dev. Tech. 2, 1–12.
总结
凋亡过程可能会通过多种不同的机制被诱发,凋亡时,细胞会产生相关的生化事件,这些生化事件发生的时间点取决于很多因素。本文所讨论的目的不是想要列出所有这些影响因素,而是将可能会对凋亡时限产生影响的因素进行简单介绍。当您进行凋亡研究设计时,请确保考虑到这些因素。请进行预实验以确定适合的分析检测条件。当选择凋亡生化标志物时要谨慎考虑,确保这个生化标志物与您的实验系统具有较高的相关性。通过建立初始剂量反应曲线,确定合适的药物浓度或者刺激强度,以有效地诱导目的细胞或组织的凋亡。在足够长的时间内、并以适当间隔的不同时间点对某一生化事件进行检测,以确保捕捉到峰活性,从而最大限度地降低基于不当的时间点的检测而得到的错误结论。 |
|